A mindennapi életben az olyan fogalmak, mint hőmérséklet, nyomás stb... a mikrovilágban lévő nagy számú részecske viselkedésének az átlagaként jön létre. Néhány köbcentiméter levegőben több milliárd részecske található. Általában az egyes részecskék állapotát nem tudjuk külön-külön vizsgálni, megfigyelni. Ilyen módon az elemi részecskék sebességét és pozícióját nem lehet tetszőleges pontossággal egyszerre megvizsgálni. Több olyan mérhető fogalom pár van, amelyet egy időben nem lehet egyszerre mérni. Ezt hívják Heisenberg féle határozatlansági relációnak.
Ilyen fizikai mennyiségek
a hely és az impulzus szorzata dx*dp =>
h/ 2 (h vonás per 2)energia és az idő szorzata: dE * dt =>
h/ 2
Ha olyan kísérletet végzünk, amelyben az egyes elemi részecskék viselkedését vizsgáljuk, akkor már egy kicsit más a helyzet. Eleve sok olyan fogalom nem értelmezhető, amelyet a makrovilágban értelmezünk (nyomás, hőmérséklet pl.) és előjönnek olyan fogalmak, amelyeket a makrovilágban nem tapasztalunk.
Kvantálás - Az elemi részecskék állapota sohasem lehet tetszőleges, hanem csak bizonyos, a környezettől függő pontos energia értékeket vehet fel. Például az elektronok sem csak kóborolnak az atommagok körül, hanem csak pontosan meghatározott pályákon lehetnek.
Az atomokban az elektronok a megadott pályák állapotai között minden átmenet nélkül ugranak át az egyik állapotból a másikba, miközben fotonokat bocsátanak ki vagy nyelnek el. Nincsen köztes állapot. Ráadásul az átmenet mérhetetlenül rövid idő alatt zajlik le, gyakorlatilag végtelen sebességgel.
Perdület - spin
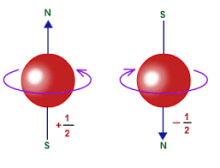
Amikor vizsgáljuk, hogy egy atom mágneses térben hogyan viselkedik, akkor azt látjuk, hogy az atom mágneses perdületének bármilyen irányú vetülete csak diszkrét értékeket vehet fel. Ez azt is jelenti, hogy az elemi részecskék perdülete sem lehet akármekkora. Nagyon sok elemi részecskének van saját perdülete és nem lehet akármekkora. A saját perdületet nevezzük spinnek.
Mik lehetnek a "környezettől függő pontos értékek"?
Ha egy elektron mondjuk az atom körül S állapotban (gömbszerű, a legegyszerűbb állapot) van és megfelelő energiájú fotonnal megvilágítjuk, akkor az energiaszintje megváltozik és egy magasabb energiaszintű állapotba kerül, majd egy idő múlva véletlenszerű időpontban visszaugrik alapállapotba és kibocsátja a két energiaszint közötti fotont. Az atommag és a környezetében lévő többi elektron határozza meg a lehetséges állapotokat. Korábban jeleztem, hogy az elektronnak van spinje (pörög). Ezt 1/2-el szokás jelölni. A spinnek két állapotát tudjuk megkülönböztetni, amit balra illetve jobbra forgásnak nevezünk. A balra pörgő és a jobbra pörgő elektronoknak az energiaszintje kissé különbözik még akkor is, ha ugyanazon az elektronpályán vannak. Ezt nem túl bonyolult kísérletekkel igazolni lehet. A kísérletek során az is bebizonyosodott, hogyha egy elektronpályára két elektront tudunk elhelyezni, akkor a két elektronnak mindig ellentétes a spinje.
Vagyis egy elektron állapotban mindig legfeljebb kettő elektron lehet ellentétes spinnel. ez a Pauli-elv.